Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2008/2021
[A propos de l'auteur]
[Droits de copie]
Reprenons l'exemple de l'aspartate transcarbamylase (ATCase) vu précédemment dans le §3. L'ATCase est la première enzyme de la voie de biosynthèse des pyrimidines. Les détails de cette chaîne de biosynthèse sont présentés en ouvrant ce lien (par clic droit dans un nouvel onglet). Mais on pourra se contenter de ce schéma :
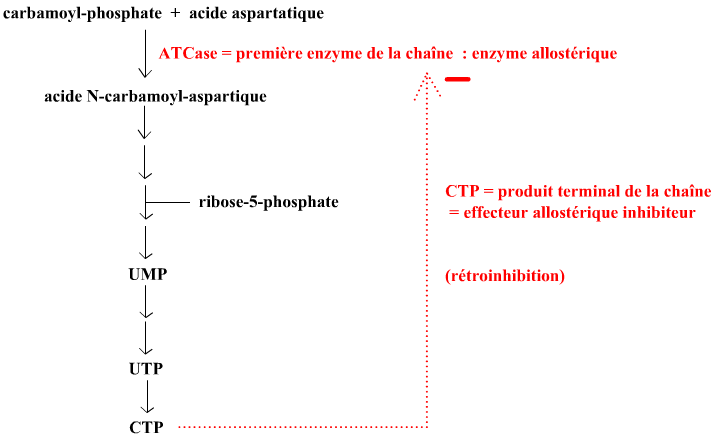
• On sait que la cytidine triphosphate (CTP) est le produit final de cette voie métabolique et que c'est une "brique élémentaire du vivant". Et on voit que cette même CTP est un ligand inhibiteur allostérique hétérotrope (type K)de l'ATCase. C'est un exemple type de rétro-inhibition par le produit final sur le premier enzyme de la voie de biosynthèse : un excès de CTP signale à la première enzyme de la voie de biosynthèse que ce n'est pas la peine de tourner à plein régime afin d'éviter la surproduction de nucléotides pyrimidiques.
• On a vu aussi que l'ATP était activateur allostérique. Peut-on dans un esprit très finaliste (donc un peu tordu) trouver une utilité physiologique à cet effet ? Les nucléotides puriques (ATP, GTP) sont fabriqués par une voie de biosynthèse totalement indépendante de la voie des pyrimidiques. Si on pense qu'il faut ATP/GTP/CTP/UTP pour la biosynthèse de l'ARN par exemple, l'ATP signalerait à la voie de synthèse des pyrimidiques que le stock de nucléotides puriques est très élevé et qu'il convient d'envisager une forte production de pyrimidiques pour équilibrer le ratio nucléotides puriques/nucléotides pyrimidiques. Tiré par les cheveux ... ?
Et pour finir ce paragraphe, un bon document pdf, à télécharger à http://www.esi.umontreal.ca/~syguschj/cours/BCM1502/Web-Notes/5c_Regulation.pdf
Voici un lien ouvrant un nouvel onglet de votre navigateur sur la régulation concertée de la biosynthèse d'un certain nombre d'acides aminés (lys, meth, thréo, ileu). De quoi réfléchir et pousser éventuellement plus loin.
Autre exemple. La thréonine désaminase des Salmonelles est une enzyme allostérique très intéressante. Elle débute la voie qui conduit de la thréonine à l'isoleucine en désaminant la thréonine en 2-oxybutyrate. Mais les enzymes
qui conduisent de l'oxybutyrate à l'isoleucine sont les mêmes que celles qui conduisent du pyruvate à la valine (une spécificité pas très stricte mais très économique ...). Et on se retrouve avec la situation suivante pour la
thréonine désaminase :
- enzyme allostérique à cinétique hyperbolique en absence d'effecteurs !
- la thréonine (le substrat !), la valine et l'isoleucine sont en compétition sur un site allostérique en dehors du site catalytique (évidemment en dehors). L'isoleucine
entraîne une inhibition (hétérotrope) avec allure sigmoïdale des cinétiques. La valine est un activateur hétérotrope.
la thréonine activateur hétérotrope (avec une efficacité moindre que la valine).
A fouiller ; pour les curieux ou les insomniaques.