Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2008/2021
[A propos de l'auteur]
[Droits de copie]
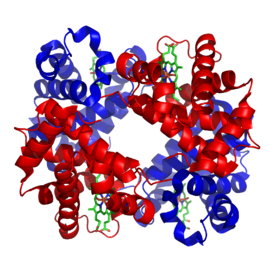
L'hémoglobine est formée par l'association de 4 sous-unités protéiques : 2 sous-unités dites α et 2 sous-unités dites β. La structure peut ainsi s'écrire α2β2. Les chaînes α et β présentent une homologie de séquence très fortement marquée et une structure spatiale très proche. Associée à chaque chaîne α ou β, on trouve une structure non protéique appelée hème. Chaque hème (4 au total, identiques) est constitué par un motif chimique porphyrine portant en son centre un ion Fe2+. Ainsi, L'hémoglobine est une hétéroprotéine, les chaînes α et β sont la partie apoprotéine et les hèmes la partie groupement prosthétique.
 |
 |
Structure de l'hémoglobine humaine. Les chaînes α et β sont en rouge et bleu,
et les hèmes en vert. |
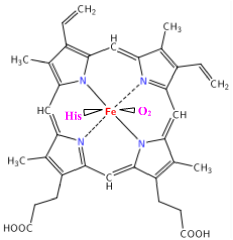
Quand l'hémoglobine est chargée en dioxygène (oxyhémoglobine), l'ion de fe2+ est
lié par six liaisons de coordinence : 4 avec 4 N de l'hème, la cinquième avec un N d'une histidine et la sixième
avec un atome d'O du dioxygène (l'autre atome du dioxygène se liant à une autre histidine).
Dans l'hémoglobine déchargée du dioxygène (désoxyhémoglobine), le fer est seulement pentacoordonné. |
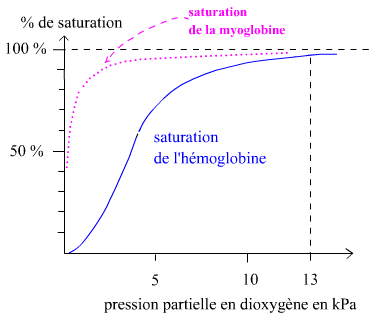
La figure de droite montre la fonction de saturation de l'hémoglobine. Elle est comparée à celle de la myoglobine. la myoglobine est une protéine des cellules musculaires. Elle leur assure un stockage de dioxygène. la myoglobine est monomérique, formée par une chaîne polypeptidique de structure très voisine de celles des chaînes α et β de l'hémoglobine et cette chaîne polypeptidique est associée à un hème. La myoglobine lie évidemment le dioxygène. Pour l'hémoglobine (Hb): 100% de saturation signifie 4 O2 par Hb α2β2 . Pour la myoglobine (Mb) : 100% de saturation signifie 1 O2 pour une Mb. la courbe de saturation de Mb est une hyperbole classique. La courbe de saturation de Hb possède une allure sigmoïde. Cette allure est due à un effet coopératif (on dit aussi homotrope positif). |
|
Et en activant le lien, vous avez droit à l'ouverture d'un cadre avec un petit commentaire physiologique. Vers le commentaire physiologique".
Le plus efficace est d'aller à l'adresse http://www.chemistry.wustl.edu/~edudev/LabTutorials/CourseTutorials/Tutorials/Hemoglobin/151_T3_hemoglobin.htm.
Voici un petit résumé de ce que vous apprendrez :
• Le hème est enchassé dans un repli hydrophobe tout juste accessible à O2
• la liaison de O2 établie une 6° liaison de coordinence du fer et ce ne sera pas sans conséquences.
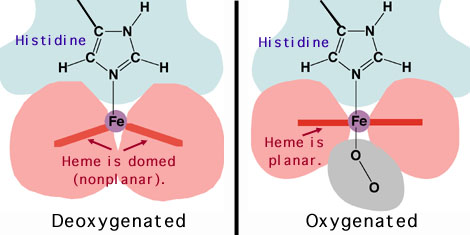 |
Les nuages électroniques du hème, de l'histidine et de O2
sont respectivement en rose, bleu et gris : ça bouge ! le fer passe de "pas dans le
plan du hème" à "en plein dans le plan". |
Et si on veut poursuivre notre affaire : quand l'O2 se lie, ça bouge et ça tire l'N de l'histidine engagé dans la liaison de coordinence vers l'hème. Ce mouvement se répercute sur tout le segment en hélice α qui porte cette fameuse histidine. Le mouvement de ce segment de cette sous-unité de la protéine va se répercuter sur un autre segment voisin de la même sous-unité ce qui va modifier la position de certains acides aminés clés de la structure spatiale ce qui va entraîner une répercussion sur la structure spatiale de l'ensemble des autres sous-unités. Un O2 se lie => une histidine bouge => changement conformationnel induit global. (Petite remarque : l'énergie de ce "mouvement" vient évidemment de l'énergie de la liaison)
Et l'effet coopératif va provenir de là :
• A l'état libre, la conformation de Hb α2β2 est ainsi faite que le site pour O2 de chacune des 2 chaînes β est inacessible ! Les chaînes α présentent en revanche un accés à O2. Même si il est très étroit cet accès existe : l'affinité pour O2 pour les chaînes α est faible.
Si une première molécule de O2 se fixe sur une chaîne α, elle va induire un mouvement conformationnel global, comme on l'a vu ci-dessus. Et en fait ce mouvement va se répercuter essentiellement sur la deuxième chaîne α qui va voir son affinité pour O2 fortement augmentée.
• Quand les 2 chaînes α ont lié chacune un O2, l'induction de changement conformationnel fait passer les 2 chaînes β en conformation à très très haute affinité pour O2. L'Hb se sature alors en O2
• D'où l'énoncé : O2 exerce un effet coopératif positif sur sa propre fixation (l'affinité s'améliore avec la première fixation). La courbe sigmoïde de saturation est une conséquence directe de ce phénomène.
Voici un petit schéma qui se veut être un résumé explicatif :
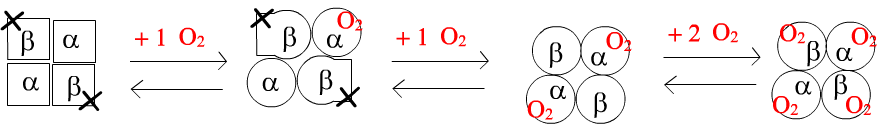
Information : Une animation sur http://fr.wikipedia.org/wiki/Allost%C3%A9rie montre très bien le changement conformationnel induit.
L'hémoglobine α2β2 possède un site de fixation pour le 1,3-biphosphoglycérate (BPG) entre les 2 chaînes β (un seul pour Hb α2β2).
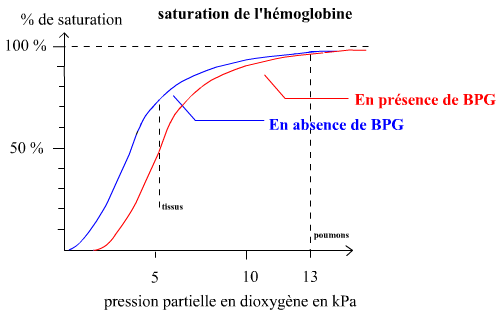 |
Seule la forme libre de Hb (forme sans O2, forme dite tendue) présente une affinité pour le BPG. Le changement conformationnel qui fait suite à la liaison des 2 premiers O2 sur les chaînes α affaibli énormément l'affinité du BPG pour son site. Autrement dit, le passage de la forme tendue vers la forme relachée (celle à 2 O2 liés sur les chaînes α) tend à expulser le BPG. De façon symétrique, plus la concentration en BPG dans le milieu est élevée, plus Hb a tendance à être maintenue sous forme tendue à faible affinité pour O2. Il vaut mieux en effet se figurer les choses comme un déplacement d'équilibre entre les formes tendues et relachées. La présence de BPG a donc des conséquences sur la courbe de saturation : plus la concentration en BPG est élevée, plus elle va être déplacée vers les pressions partielles en O2 plus élevées. |
L'effet du BPG sur la liaison de O2 est une conséquence de sa liaison sur son site, site distinct du site pour le ligand O2 : Le BPG est un effecteur allostérique (au sens premier du terme).
Ouverture d'un encadré avec commentaire physiologique.
Commençons par traiter le cas simple d'une protéine à plusieurs sites identiques indépendants.
Soit une protéine P possédant n sites de fixation pour un ligand L donné. Si on suppose que
tous les sites sont identiques et indépendants, ils présentent tous la même constante
de dissociation pour le ligand L. Ainsi pour chaque site (noté A) :
Af + Lf <-------->
AL et KD = [Af][Lf]/[AL] (relation (a))
Af représente les sites libres, Lf le ligand libre et AL les complexes site-ligand lié.
Le nombre total de sites de fixation est égal à la somme du nombre de sites libres et de sites occupés. On obtient ainsi la relation (b) : [Af] = n[P]-[AL]. Où [P] désigne la concentration totale en protéine P.
On montre ainsi facilement, en combinant (a) et (b), que :
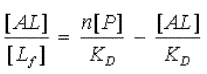
Soit ν le nombre de sites occupés par protéine. On a ν = [AL]/[P].
On peut réinjecter dans la formule ci-dessus en divisant chaque membre de l'égalité par [P]. On obtient :
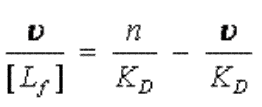
Il apparaît ainsi que la fonction ν/[Lf] = f(ν) (qui est appelée fonction de Scatchard) devrait être une droite d'abscisse à l'origine n et de coefficient directeur -1/KD.
Examinons les résultats obtenus avec l'hémoglobine : 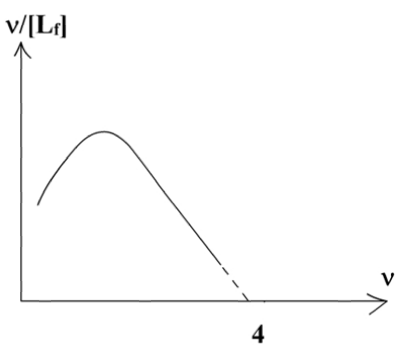 |
On retrouve les 4 sites par Hb, mais le traitement "hypothèse des sites indépendants" ne fonctionne qu'aux valeurs de ν élevées et pas du tout aux valeurs de ν faibles. Et effectivement, les sites ne sont pas indépendants, il y a, comme on l'a vu, coopérativité positive pour la liaison de O2. |
Pour les travailleurs acharnés, un joli TD sur http://biochimej.univ-angers.fr/Page2/TexteTD/2LicenceUE1/HEMOGLOBINE/3CorrectionOXY/0IndexCorrecOXY.htm.