Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2008/2021
[A propos de l'auteur]
[Droits de copie]
Que signifie ce titre bien compliqué ? Il signifie :
• la fixation du substrat sur ses sites présente un phénomène de coopérativité positive lors de la liaison du substrat.
L'enzyme, oligomérique, existe sous plusieurs formes conformationnelles. Chaque sous-unité constitutive
portant un site catalytique peut se trouver à l'état tendu (faible affinité pour le substrat) ou relaché (forte affinité pour le substrat).
• La liaison du substrat sur un site à l'état tendu induit une transconformation plus ou moins globale déplaçant les
autres sous-unités vers l'état relaché (cf. ce qui a été vu dans le paragraphe précédent concernant l'hémoglobine). A la pace d'effet coopératif positif, on aurait pu utiliser
le synonyme "effet homotrope positif" (voir paragraphe 5 sur le vocabulaire).
• En signalant dans le titre que l'effet coopératif est de type K, on a signifié que les différences de propriétés "enzymatiques" entre les états tendus et relachés
des sous-unités étaient au niveau de l'affinité pour le substrat (et pas au niveau de la vitesse réactionnelle).
• Et finalement, les propriétés ci-dessus expliquent l'allure sigmoïde fonctions vi=f([S]).
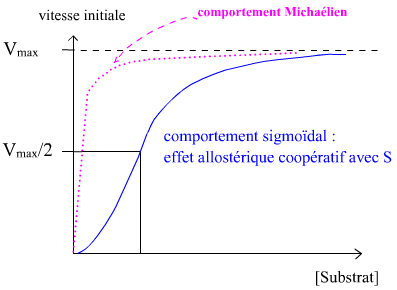
Remarque. Dans le cas présenté, l'effet coopératif voit l'occupation d'un site catalytique améliorer les propriétés d'affinité des autres sites catalytiques identiques de l'enzyme. On parle alors d'effet coopératif positif de type K. Un synonyme étant effet homotrope de type K (tout ça pour encombrer un peu plus la mémoire des étudiants de mots compliqués ? ....)
Au sens strict, Un effecteur allostérique remplit 3 conditions :
• C'est une molécule autre que le(s) substrat(s) ayant un ou plusieurs sites
de fixation sur l'enzyme.
• Le(s) sites en question est(sont) distinct(s) du site catalytique.
• La liaison de l'effecteur allostérique entraîne des changements conformationnels propagés à l'échelle de
l'enzyme entière et à l'origine d'une activation ou d'une inhibition.
On parlera ainsi d'activateurs et d'inhibiteurs allostériques.
Remarque. L'effecteur allostérique se lie à un site totalement distinct et éloigné du site catalytique et la liaison de cet effecteur modifie (par changement conformationnel induit) les propriétés du site catalytique pour son substrat : cet effet est qualifé d'effet hétérotrope. A mettre en comparaison avec l'effet coopératif, homotrope vu dans le paragraphe précédent. Voir aussi le paragraphe 5 de vocabulaire.
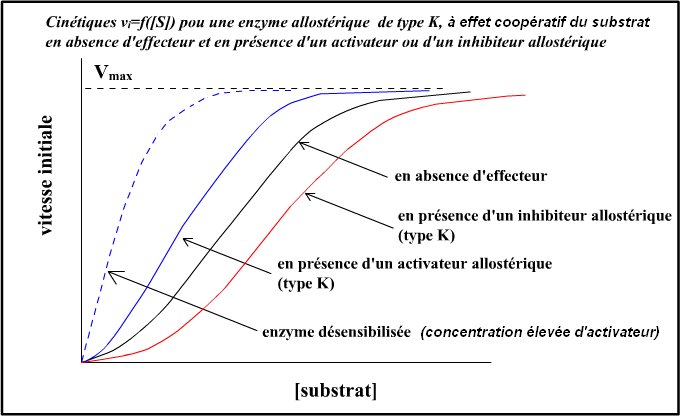
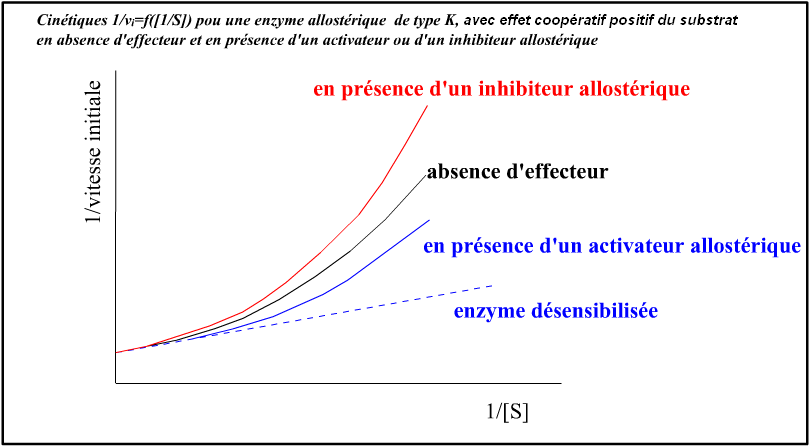
Dans ce qu'on appelle les systèmes K (les plus classiques), les changements conformationnels dus à la liaison des effecteurs allostériques modifient l'affinité
des différentes sous-unités pour le substrat catalysé et pas le coefficient catalytique (k0, Vmax) :
• La liaison d'un inhibiteur allostérique (sur ses sites spécifiques) va favoriser l'état
tendu à faible affinité pour le substrat. On peut évidemment raisonner en terme de déplacement d'équilibre ;
• La liaison d'un activateur allostérique (sur ses sites spécifiques) déplace l'enzyme vers l'état relaché à forte affinité pour le substrat.
A concentration saturante en activateur, toutes les sous-unités de l'enzyme sont déplacées sous la forme relachée : le comportement de l'enzyme
devient Michaélien (il ne peut plus y avoir de comportement sigmoïdal puisque tout effet coopératif du substrat est aboli puisque l'enzyme n'existe plus que sous la
même forme, relachée). On parle parfois de "désensibilisation de l'enzyme".
Voici des illustrations graphiques pour une enzyme allostérique montrant un effet coopératif du substrat et un effecteur activateur et un effecteur inhibiteur allostérique, pour un système K :
L'aspartate transcarbamylase d'E. coli (EC 2.1.3.2) (ATCase) catalyse la première réaction de la voie de biosynthèse qui conduit aux nucléotides pyrimidiques :
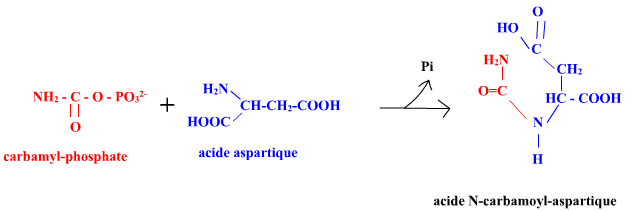
C'est une enzyme allostérique dont le comportement suit les donnée présentées ci-dessus :
• cinétique sigmoïdale vi=f([aspartate]) en absence d'effecteur : effet coopératif positif (homotrope positif) de type K du
substrat aspartate ;
• CTP = inhibiteur allostérique, type K (effet hétérotrope inhibiteur de type K). Et des recherches ont montré que la fixation du CTP sur ses propres sites de liaison était coopérative mais à coopérativité négative !
(CTP = effecteur homotrope négatif de sa propre liaison).
• ATP = activateur allostérique, type K (effet hétérotrope activateur de type K).
Dans les systèmes K, la protéine passe d'une forme à l'autre sous l'influence de la liaison d'un ligand qui peut être le substrat, ou un effecteur. Les différentes formes ne présentent pas la même affinité pour le substrat.
On peut revoir le vocabulaire donné au paragraphe 5. Pour qualifier par exemple le fait que la liaison d'un activateur A favorise la liaison d'autres molécules de A , on peut parler d'effet homotrope positif de A sur sa propre liaison. Et pour qualifier le fait que l'activateur A déplace vers le(s) états à forte affinité pour le substrat S on parlera d'effet hétérotrope positif de A.
Dans les systèmes V, la protéine passe d'une forme à l'autre sans changer d'affinité pour ses ligands, mais c'est la vitesse de l'acte catalytique
qui va varier : c'est à dire le coefficient catalytique k0, donc la Vmax.
Et il faut alors savoir regarder les choses de très près, une allure cinétique qui semble à première vue michaélienne peut cacher de l'allostérie !
Voici un lien
vers un exemple pour ceux qui veulent en savoir plus : lien vers le supplément.
Et tous les cas plus complexes, où affinité et k0 sont modifiés paar les mouvements transconformationnels d'allostéries ... Certains auteurs parlent alors d'allostérie K-V.
Les pyruvate kinases (PK) (ATP:pyruvate 2-O-phosphotransferase, EC 2.7.1.40, PK) sont des enzymes clés de la glycolyse et catalysent la réaction suivante :
phosphoenolpyruvate (PEP) + ADP = pyruvate + ATP
Le fructose-1,6-biphosphate est un effecteur de régulation des pyruvate kinases.
Les mammifères proposent quatre isoenzymes pyruvate kinases (M1, M2, R et L). Ce sont des homotétramères codés par 2 gènes différents, PKLR pour les formes L et R et PKM pour les formes M1 et M2. Dans la suite on s'intéresse aux seules formes M1 et M2. C'est l'épissage alternatif exclusif de l'ARN pré-messager du gène PKM qui conduit aux 2 isoenzymes M1 et M2. M1 et M2 diffèrent ainsi de 21 résidus aminoacyls sur le segment protéique allant du résidu 389 au résidu 433. Ce segment forme 2 hélices alpha engagées dans l'association des sous-unités en homotétramère. Dans le document ci-dessous adapté de Ikeda, Noguchi, Allosteric Regulation of Pyruvate Kinase M2 Isozyme Involves a Cysteine Residue in the Intersubunit Contact, The Journal of Biological Chemistry, 1998 Vol. 273 : 12227-12233, M2.WT désigne l'enzyme M2 de type sauvage et M2.C423L un mutant de M2 pour lequel la cystéine en position 423 a été remplacée par une leucine.
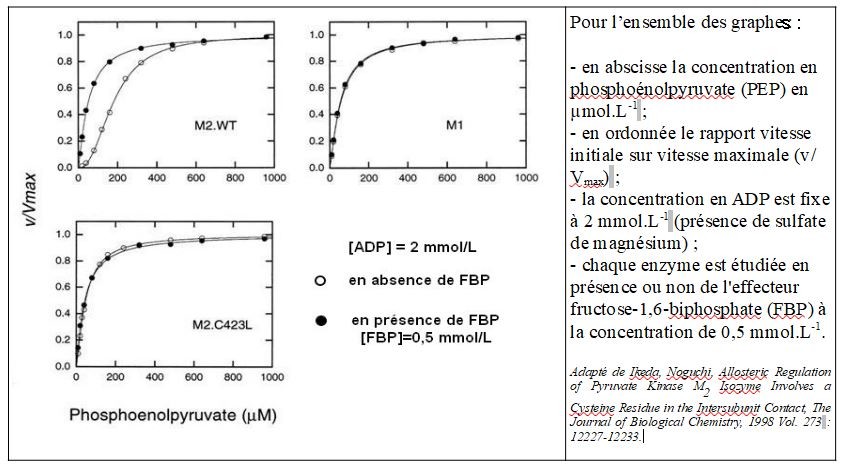
Conclusions :
Et pour poursuivre cet exemple. Dans le même article, les auteurs utilisent l'inhibiteur phénylalanine de la PK.
Conclusions :
L'hypothèse de l'existence de 2 formes, tendue et relâchée, est cohérente avec les résultats expérimentaux proposés ci-dessus mais demande évidemment d'autres preuves. Dans "Israelsen WJ, Vander Heiden MG. Pyruvate kinase: Function, regulation and role in cancer. Semin Cell Dev Biol. 2015;43:43-51. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4662905/" vous trouverez un point sur cette question. Avec de très belles images structurales ! Allez voir !