Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2009/2013
[A propos de l'auteur]
[Droits de copie]
On suppose que le modèle idéal simple présenté au paragraphe 1 est applicable.
La technique proposée dans la suite fait appel à un capteur à dioxygène et à des mesures cinétiques d'évolution de dioxygène dissous dans le bioréacteur lors de phases d'arrêt de l'aération et de reprise d'aération. Les mesures n'auront un sens évident que si le temps de réaction du capteur est rapide devant la cinétique du phénomène à étudier. En pratique, il suffit que le temps de réponse du capteur soit suffisamment bref. (Si ce n'est pas le cas, les calculs de KLa peuvent néanmoins être réalisés en tenant compte des caractéristiques dynamiques du capteur à dioxygène. La résolution des équations complexes obtenues n'est pas envisagée dans cette page. Voir la bibliographie proposée qui traite ce cas ...)
Le bioréacteur est en culture sous un volume donné de milieu de composition donnée et selon une aération et une agitation donnée. On suppose
que les conditions d'aérations conduisent à des concentrations en dioxygène dissous supérieures aux valeurs basses critiques.
A un instant donné et pour une durée brève (brève signifie une durée assez courte pour que l'accroissement de biomasse puisse être considéré
comme négligeable donc OUR = QO2 X constant), on peut considérer que la concentration en dioxygène dissous est en état stationnaire quasi constante (CLeq)réglée par l'équilibre dynamique :
dC/dt = 0 = OTR - OUR = KLa(C*-CLeq) - QO2 X
Cet "équilibre dynamique sur une durée brève" est représenté par la période "équilibre dynamique" sur la courbe ci-dessous. A partir de cette
brève période, on va conduire une expérience d'arrêt de l'aération et de reprise de l'aération selon les indications de la figure ci-dessous. Et
on pourra en déduire kLa.
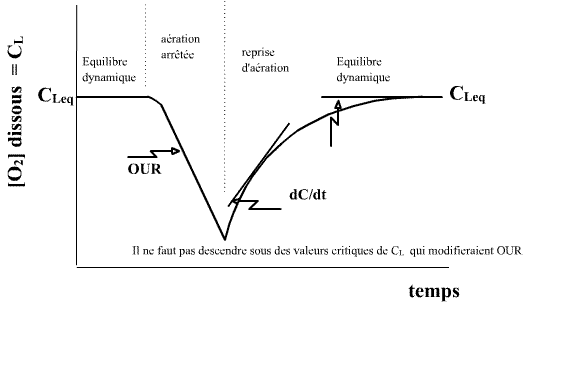
Note importante : la durée totale de l'expérience doit être suffisamment brève pour que l'accroissement de biomasse soit nul (négligeable) pendant le temps de l'expérience. Ainsi "l'équilibre dynamique" est le même en fin et début d'expérience (comme indiqué sur la figure ci-dessus).
Durant cette phase où [O2] dans le milieu de culture est non limitante, la demande en O2 de la biomasse est constante (supposée constante car la durée de l'expérimentation est brève). OUR = QO2 X est constant car X ne varie pas sur une durée très brève. Ainsi cette phase doit-elle présenter l'allure d'une droite et le coefficient directeur de cette droite est OUR.
L'équation de réoxygénation du milieu est, on l'a vu :
dC/dt = KLa(C*-C) - OUR (a)
C'est une équation différentielle C(t) très simple à résoudre. Et c'est ce qu'on va faire, mais il serait bien de connaitre
OUR et de l'injecter dans l'équation différentielle avant de la résoudre. Et c'est là où ça peut
paraître surprenant, mais on ne va pas utiliser la phase d'arrêt d'aération pour connaître OUR mais
les 2 phases brèves initiales "d'équilibre dynamique".
Comme on l'a dit précédemment, on supose que la croissance microbienne est nulle pendant la durée (brève) de
la manipulation. Les états initiaux et finaux sur le graphique correspondent à un état dynamique
stationnaire du bioréacteur pour lequel [O2]milieu culture ≈ constante = CLeq.
On peut donc écrire dC/dt = 0 = KLa(C* - CLeq) - OUR
soit OUR = KLa(C* - CLeq)
On peut alors reprendre l'équation différentielle de la phase de reprise d'aération (a) et y réinjecter la valeur
de OUR = KLa(C*-CLeq)
On obtient : dC/dt = KLa(C* - C) - KLa(C* - CLeq)
En factorisant KLa, on peut écrire : dC/dt = KLa[(C*-C) - (C* - CLeq)]
Qui donne : dC/dt = KLa(CLeq - C)
On se retrouve ainsi confronté à une équation différentielle très simple qui s'intègre facilement en :
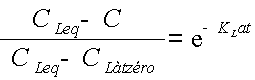 Avec Càtzéro = concentration en dioxygène dissous au nouvel instant t=0. Le nouvel instant t=0 étant choisi en début de la
phase de reprise d'aération. (Le paragraphe d'application pratique rendra tout ça évident).
Avec Càtzéro = concentration en dioxygène dissous au nouvel instant t=0. Le nouvel instant t=0 étant choisi en début de la
phase de reprise d'aération. (Le paragraphe d'application pratique rendra tout ça évident).
Et comme on a une forme exponentielle, on va linéariser en passant en Ln, ce qui va donner :
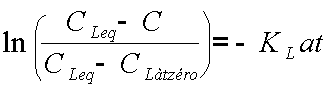 Une droite qui passe par l'origine et donc la pente est négative avec
KLa pour valeur !!
Une droite qui passe par l'origine et donc la pente est négative avec
KLa pour valeur !!
Note : Pour ceux pour qui l'équation différentielle proposée n'est pas simple et qui veulent une démonstration simple de résolution, vous pouvez ouvrir une nouvelle fenêtre qui propose " la résolution pas à pas de l'équation différentielle et sa linéarisation".
Note : Les capteurs à O2 fournissent des données exprimées en %d'O2 directement exploitables. Il est évidemment inutile de chercher des expressions d'O2 en mmol/L ...
5.4 Exemple pratique (pratique pour comprendre ...)
Voici les résultats d'une manipulation conduite par des étudiants de BTS biotechnologies (fin 2009). Un fermenteur de laboratoire contenant 1L de milieu de culture LB à 37°C est ensemencé avec une souche E. Coli de 18 heures sur milieu LB. La vitesse de rotation de la turbine rushton est de 200 rpm (pour avoir un KLa faible facile à mesurer), le débit d'aération est de 1 VVM (60 L/h, 0,3 bar). Les mesures ont été conduites environ 40 minutes après l'inoculation. Le temps de réponse de la sonde ampérométrique à dioxygène utilisée a été mesuré :pour un passage de 0 à 100%, on obtient 90 % en moins de 25 s. On verra ainsi par la suite que ce temps est suffisament faible pour valider les mesures pendant la phase de reprise d'aération.
Voici les résultats obtenus :
temps |
0 |
15 |
30 |
45 |
60 |
75 |
90 |
105 |
120 |
135 |
150 |
165 |
180 |
195 |
210 |
225 |
240 |
255 |
270 |
285 |
300 |
330 |
[O2] |
40,5 |
40,6 |
40,4 |
36,5 |
30,9 |
23 |
15,4 |
7,5 |
11,9 |
16,5 |
19,6 |
24,4 |
26,3 |
29,5 |
32,5 |
34,4 |
35,6 |
36,9 |
37,7 |
39,3 |
40,5 |
40,4 |
|
Etat dynamique de la culture |
| |
L'aération est arrêtée |
| |
L'aération a été reprise |
|||||||||||||||||
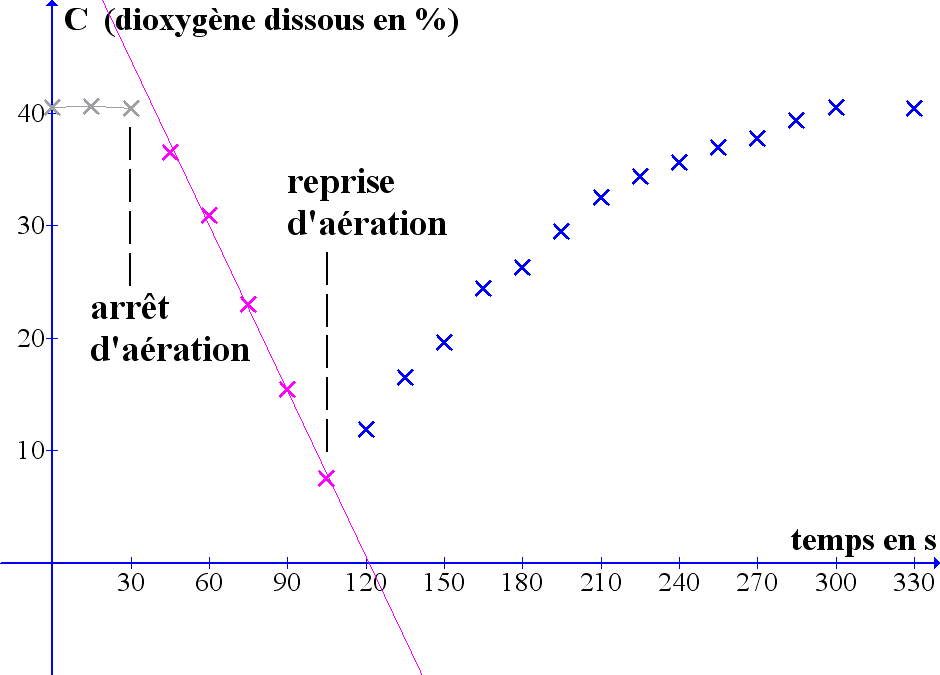
Pour calculer KLa, on va utiliser la zone connue de reprise d'aération, c'est à dire la partie :
temps |
120 |
135 |
150 |
165 |
180 |
195 |
210 |
225 |
240 |
255 |
270 |
285 |
300 |
330 |
[O2] |
11,9 |
16,5 |
19,6 |
24,4 |
26,3 |
29,5 |
32,5 |
34,4 |
35,6 |
36,9 |
37,7 |
39,3 |
40,5 |
40,4 |
Pour la conduite des calculs, on va utiliser les données ci-dessus avec une nouvelle base de temps (120 est le nouveau temps zéro). Et on va appliquer le modèle de résolution obtenu au §3.3 avec CLeq=40,5 et CLàtzéro=11,9 pour déterminer KLa. Le modèle n'est évidemment pas appliqué aux 3 derniers temps, temps pour lesquels on a presque retrouvé CLeq.
temps |
0 |
15 |
30 |
45 |
60 |
75 |
90 |
105 |
120 |
135 |
150 |
[O2] |
11,9 |
16,5 |
19,6 |
24,4 |
26,3 |
29,5 |
32,5 |
34,4 |
35,6 |
36,9 |
37,7 |
Ln((40,5-C)/(40,5-11,9)) |
0 |
-0,175 |
-0,314 |
-0,575 |
-0,700 |
-0,956 |
-1,274 |
-1,545 |
-1,764 |
-2,072 |
-2,324 |
On construit le graphe Ln((40,5-C)/(40,5-11,9))=f(t). ça paraît aligné. Régression linéaire et on obtient KLa.
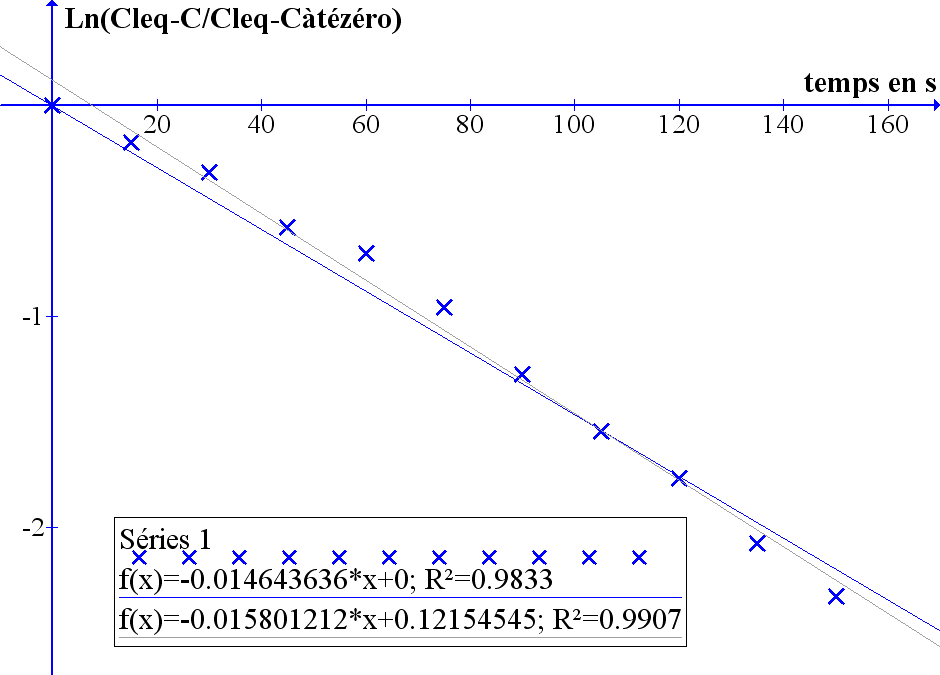
D'où un KLa estimé vers 0,015 s-1 dans les conditions proposeés.
Et on peut penser que cette estimation est à peu près correcte puisque la réoxygénation du biorécteur a demandé environ 150 s (de 11,9% à 40%) alors
qu'on a utilisé une sonde "beaucoup plus rapide" puisque capable de répondre en moins de 20-30 s à cette variation de dioxygène dissous ...)