Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2009/2013
[A propos de l'auteur]
[Droits de copie]
0. Solubilité du dioxygène dans les milieux de culture, loi de Henry
[O2] dissous peut être un élément critique limitant dans un procédé aérobie.
De nombreuses cultures de microorganismes réalisées à des fins de productions biotechnologiques concernent des germes de type aérobie qui consomment donc du dioxygène (O2 est l'accepteur terminal des électrons du métabolisme énergétique respiratoire).
O2 est peu soluble dans les milieux aqueux et la concentration en O2 dissous peut être un élément critique limitant dans un procédé. Pour illustrer simplement, on peut, par exemple, rappeler et appliquer le modèle de limitation de la vitesse spécifique de croissance de Monod à O2 :
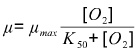
Un ordre de grandeur pour K50 : 10-5 mol/L. Donc en admettant qu'à partir de 10 fois K50 le dioxygène ne sera plus limitant, on obtient des valeurs critiques de concentration en dioxygène dissous vers 10-4 mol/L soit de l'ordre de 5% à 50% de saturation - selon les espèces - sous aération par l'atmosphère terrestre vers 30 °C. (Voir le tableau de solubilité ci-dessous pour vérifier)
La solubilité du dioxygène dans une solution aqueuse suit la loi de Henry. Voici la loi de Henry :
A l'équilibre (on dit aussi à saturation), il existe une relation de proportionalité entre la pression partielle (Pi) d'un soluté volatile (dans notre cas O2) et
la fraction molaire (xi) de celui-ci dans la solution. Du moins aux faibles concentrations en soluté volatile (ce qui sera toujours le cas pour O2
peu soluble). Soit sous forme mathématique :
Pi = xi . Ki. Avec Ki
coefficient qui dépend du soluté, du solvant, de la température (en Pa-1).
De façon plus pratique, on utilise presque toujours la forme suivante :
Pi = c*i . Hi
Pi : pression partielle du gaz i dans l'atmosphère gazeuse c*i : concentration en gaz dissous i à l'équilibre (saturation) ; Hi : coefficient de Henry
pour le gaz dissous considéré et le liquide à la température de travail (Hi, en L.Pa.mol-1)

Voici ce que donne la loi de Henry appliquée à O2 et à l'eau pure.
Avec une atmosphère terrestre classique à pression totale de 1013 hPa et 21% de dioxygène soit 213 hPa de pression partielle | ||
Température de l'eau en °C | Coef. de Henry en L.Pa.mol-1 |
Solubilité de O2 en mmol/L et mg/L |
0 | 47 106 | 0,45 mmol/L |
20 | 76 106 | 0,28 mmol/L |
37 | 108 | 0,21 mol/L |
60 | 125 106 | 0,17 mol/L |
100 | 0 | 0 mol/L |
La solubilité du dioxygène diminue avec l'ajout d'électrolytes, de glucides ... dans l'eau. Donc la solubilité dans les milieux de culture est plus faible que dans l'eau. Le tableau ci-dessus montre bien la diminution de solubilité avec la température ! Remarque : on notera l'insolubilité à ébullition : Un milieu après ébullition ou au sortir d'un autoclavage est désoxygéné !
Faible solubilité de O2 et concentration critique en oxygène de l'ordre de 5 à 50% de saturation => nécessité d'assurer un bon transfert permanent d'O2 dans les bioréacteurs à process aérobie
Par suite de la faible solubilité de O2 dans les milieux de culture et de sa consommation par les microorganismes, le maintien d'une concentration suffisante en O2 exige un apport permanent par une alimentation en air ou en un gaz contenant de l'O2. La capacité à transférer de l'O2 dans un milieu de culture en bioréacteur dépend d'un grand nombre de paramètres de fonctionnement, notamment le débit d'aération, la géométrie du réacteur, la structure du système d'agitation (et sa vitesse de rotation), la température et la nature du milieu de culture...
La capacité à transférer de l'O2 dans un milieu de culture en bioréacteur (en quantité d'O2 de par unité de volume et par unité de temps) va souvent se comporter
en point critique limitant pour un process aérobie.
Le coefficient de transfert volumétrique (KLa, en temps-1) permet de chiffrer la capacité
qu'on a à oxygéner un milieu de culture en bioréacteur dans des conditions données.
C'est le sujet des paragraphes qui suivent !