3. Etude de cas n°3 (dosage en photométrie d'émission atomique de flamme (FEP) avec appareil à double canal)
3.1 Présentation d'un dosage de potassium avec étalon interne lithium
On utilise un photomètre d'émission atomique de flamme à 2 canaux pour doser le potassium déchantillons biologiques liquides. Le faisceau de dosage du potassium est réglé sur les raies 766,5-769,5 du potassium. Le lithium est supposé totalement absent des échantillons à doser (le dosage proposé n'est valable que pour des échantillons dépourvus de lithium !!!). Il est utilisé comme étalon interne. Le canal pour létalon interne est ainsi réglé sur la raie à 671 nm du lithium
3.2 Etablissement d'une fonction d'étalonnage
On va étalonner l'analyse avec une série d'étalons de concentrations variables en potassium
mais contenant aussi l'autre étalon -l'étalon interne- en l'occurence le lithium.
On réalise 5 mélanges étalons qui sont mesurés selon les indications du tableau suivant :
|
T0 |
T1 |
T2 |
T3 |
T4 |
T5 |
|
Étalon [KCl] à 5,00 mmol/L en mL |
0 |
1 |
2 |
5 |
15 |
10 |
|
Etalon [LiCl] à 5,00 mmol/L en mL |
0 |
10 |
10 |
10 |
20 |
10 |
|
Eau bidistillée en mL |
X |
qsp 100 en fj* |
qsp 100 en fj |
qsp 100 en fj |
qsp 200 en fj |
qsp 100 en fj |
|
Emission relative sur le faisceau K |
0 |
40 |
83 |
203 |
307 |
402 |
|
Emission relative sur le faisceau Li |
0 |
198 |
203 |
199 |
201 |
197 |
* fj signifie fiole jaugée
Pour chaque signal d'émission potassium mesuré, si l'appareil était "parfait",
la valeur du signal (Set)
serait parfaitement proportionnelle à la concentration de l'analyte (cet)selon un coefficient de réponse caractéristique
(ket) :
cet = ket * Set (relation (a), appareil idéal)
(Note : cette relation est une donnée de base liée à la technique d'émission atomique de flamme, voir
éventuellement un cours à ce sujet)
Pour chaque signal d'émission lithium mesuré, si l'appareil était "parfait",
la valeur du signal (Si)
serait parfaitement proportionnelle à la concentration de l'analyte (ci)selon un coefficient de réponse caractéristique
(ki) :
ci = ki * Si (relation (b), appareil idéal)
On remarque "malheureusement" que les signaux obtenus pour le lithium sont sensiblement différents
alors que la concentration en lithium de tous les étalons est la même. Et ceci au delà
des imperfections sur la qualité des pipetages.
Ceci est lié à
des dérives au niveau de l'appareil : dérives au niveau du débit de nébulisation vers la flamme,
dérives de température de flamme, dérives au niveau de la photoréception et de
l'amplification ... Les facteurs de réponse sont constants en théorie mais évoluent en
fait en fonction des dérives de l'appareillage ...
Et c'est bien ce qui nous ennuie a priori pour
pouvoir tracer une fonction d'étalonnage de grande qualité avec de simples solutions
étalons de potassium!
Cependant pour une injection donnée dans l'appareil "imparfait" mis en oeuvre
(on injecte une même solution qui contient
le lithium étalon et le potassium étalon),
les relations (a) et (b) peuvent être "désidéalisées" par :
cet = ket * f * Set
(où f désigne un facteur lié aux fluctuations et dérives de l'appareillage pour
le potassium, f fluctue de façon inconnue)
ci = ki * f' * Si
(où f' désigne un facteur lié aux fluctuations et dérives de l'appareillage pour
le lithium, f' fluctue de façon inconnue)
Etablissons le rapport de ces 2 égalité, on obtient :
cet / ci = (ket / ki) * (f/f') *
(Set / Si)
Si on admet que f/f' est constant pour une série de mesures, c'est à dire que les fluctuations et les dérives touchent
à l'identique les 2 canaux de mesure potassium et lithium. Et ceci est vrai si on se
réfère à la construction des photomètre d'émission atomique de flamme bifaisceaux. Alors on peut dire que
(ket / ki) * (f/f') est constant dans une série de mesures.
Voilà donc la relation d'étalonnage intéressante et c'est :
(Set / Si) est proportionnel à
(cet / ci)
On se livre aux calculs, on trace (Set / Si) = f( (cet / ci) ; et on obtient :
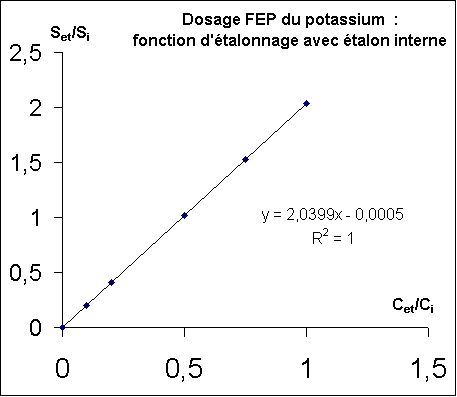 |
Pour construire le graphe présenté on a exprimé les concentrations potassium
et en lithium dans les diverses solutions étalons selon les données du tableau de résultats précédent. |
3.3 Mesure d'un échantillon donné
Un essai est réalisé ainsi : on ajoute 10,00 mL dune solution étalon de lithium à 5,00 mmol/L à 90,00 mL déchantillon à doser (grâce à un ajustage en fiole jaugée). On obtient une émission de 199 pour le canal lithium et de 197 pour le canal potassium.
Le rapport des signaux est de 0,98995. La fonction d'étalonnage associe cette valeur à
un rapport de concentration du potassium au lithium de 0,4855.
La concentration en lithium dans l'essai analysé était de 500 µmol/L. On en déduit donc
une concentration en potassium dans l'essai analysé est de 242,8 µmol/L (v/v).
Compte tenu de la dilution réalisée dans la fiole jaugée, on déduit :
[potassium]"échantillon à doser" = 242,8 * 100/90 # 270 µmol/L .
3.4 Conclusion
On voit l'intérêt de l'étalon interne dans ce dosage :
On ne connait pas l'état de dérive de l'appareillage lors de chaque mesure de signal, mais
on est en droit de d'énoncer qu'elles se produisent selon la même proportion pour l'étalon
interne et pour l'analyte à mesurer (ça, il faut bien comprendre qu'on le sait par une
connaissance du fonctionnement de l'appareil !!). Ainsi, C'est l'étalon interne
qui peut nous renseigner à chaque mesure de signal. Et la qualité des mesures est ainsi
améliorée (fidélité).
Remarque. Pour qui y regarde de près, l'étalonnage interne pratiqué ici
compense aussi les erreurs sur les ajustages des fioles jaugées utilisées dans la gamme.
Pas les pipetages, pas pour l'essai comme il est réalisé.
Voyez aussi comment calculer l'exemple ci-dessus de façon plus générale et plus formelle en lisant le paragraphe 4.
3.5 Bibliographie
J.P. Péré, Techniques spectroscopiques en biochimie analytique, CRDP Bordeaux-Aquitaine (1999).