Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2020
[A propos de l'auteur]
[Droits de copie]
![]()
 |
|
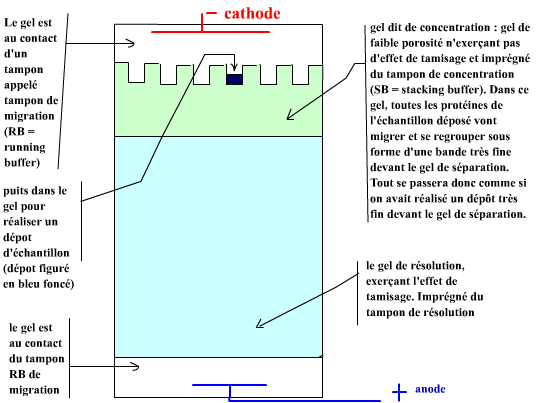
Le montage met en oeuvre 3 tampons différents compartimentés sur 4 domaines : le réservoir à la cathode, le gel de concentration, le gel de résolution, le réservoir à l'anode. Le montage est dit en "système de tampons discontinus". Ce système à été mis au point pour permettre au gel de concentration d'assurer la concentration des micelles SDS-unité polypeptidique des échantillons sur une bande de très faible épaisseur au niveau de l'arrivée au gel de résolution. Ainsi on dépose "grossièrement et pas très concentré" dans les puits et on obtient des dépôts très fins très concentrés à l'arrivée devant le gel de résolution. Ce système fait appel à un effet électrophorétique un peu complexe appelé isotachophorèse. Vous avez 2 solutions : accepter le fonctionnement du gel de concentration comme une boite noire ou essayer de le comprendre ... en lisant l'item 3 du menu de gauche "effet concentration". |
Voici une composition possible pour les différents
tampons :
- tampon de migration aux 2 bacs d'électrodes : [Tris-HCl]
= 25 mmol/L ; [glycine] = 192 mmol/L ; [SDS] = 1 g/L ; pH
8,3.
- tampon de concentration : le gel de concentration (en
général %T = 3% et %C = 2,67%) est
imprégné en tampon [tris-HCl] = 0,125 mol/L pH 6,8
avec [SDS] = 1 g/L .
- tampon de résolution : le gel de résolution est
imprégné en tampon [Tris-HCl] = 0,375 mol/L pH 8,8
avec- [SDS] = 1 g/L .
• 1 |
On prépare le montage d'électrophorèse (cf schéma ci-dessus) |
• 2 |
On prépare les échantillons et les
protéines marqueurs de taille : La solution de protéines marqueurs de taille est traitée de la même façon. |
• 3 |
C'est alors la phase de réalisation des dépôts, à l'aide de pipettes mécaniques avec des poites fines. On n'oublie pas de faire un plan ... |
• 4 |
Puis on met sous tension : On laisse migrer un certain temps ... pas trop quand même, le colorant marqueur est là pour nous guider. |
• 5 |
Et y'a plus qu'a démouler, repérer le gel, repérer la migration du colorant, enlever le gel de concentration et mettre à révéler. Pour les s'informer concernant les techniques de révélation , voir l'item 4 "révélations" dans le menu à gauche. |