Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour nov.2004/2019
[A propos de l'auteur]
[Droits de copie]
![]()
Le phage P1 est "le phage le plus célèbre" pour la réalisation de transductions généralisées sur souches E. coli. Le qualitif "généralisée" sera expliqué à la fin de cette page.
Le phage P1 est un à ADN double brin circulaire. C'est un phage qui peut donner un cycle productif lytique ou donner une bactérie lysogène. A l'état lysogène l'ADN du phage est sous forme double brin circulaire, comme un plasmide (et l'ADN phagique se contente de se multiplier en même temps que la bactérie et "dort", cf. un cours sur les phages et la lysogénie). Pour les expériences de transduction avec P1 on utilise généralement des mutants P1 incapables de lysogénie.
Comment réaliser une transduction généralisée avec un phage P1 ?
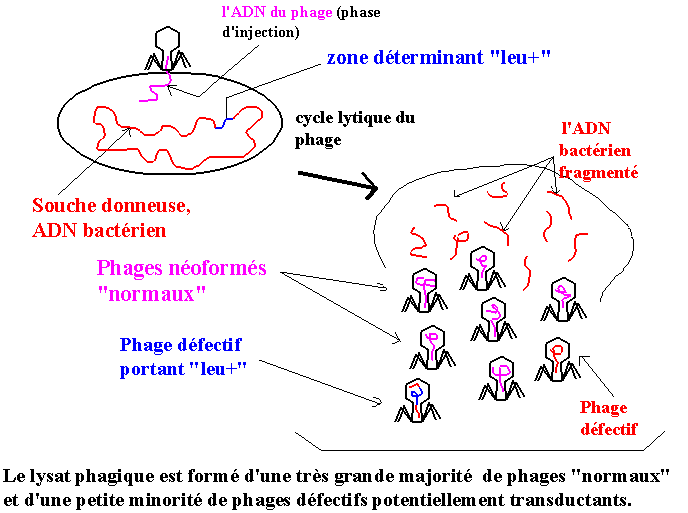
Dans une première étape, on produit un lysat phagique en inoculant le phage P1 à une souche qui sera la souche donneuse :
Au cours d'un cycle productif phagique, l'ADN bactérien est détruit par une désoxyribonucléase codée par le phage
infectant. Lors de l'encapsidation de l'ADN phagique, un fragment d'ADN bactérien peut être encapsidé
par erreur, de temps en temps, en lieu et place de l'ADN phagique néosynthétisé
(évidemment, la taille du fragment d'ADN bactérien doit être proche de celle de l'ADN phagique,
2% de l'ADN chromosomique bactérien comme ordre de grandeur).
Ainsi la population phagique néoformée obtenue (le lysat phagique) est constituée
pour l'essentiel de phages descendant identiques à leur parent et de rares phages
ayant incorporé de l'ADN bactérien. (Ces derniers sont infectieux mais défectifs :
la capside est "normale", les étapes d'adsorption puis d'entrée de l'ADN ne seront pas modifiées mais
le génome entrant ne codera plus un cycle phagique.)
Dans une deuxième étape, on va inoculer le lysat phagique obtenu avec la souche donneuse à une souche qui sera la souche receveuse :
On travaille avec une MOI (multiplicité d'infection) qui assure que
statistiquement une bactérie n'est pas infectée ou est infectée par un seul phage. Deux situations sont possibles pour chaque bactérie infectée:
• Cas le plus fréquent. Infection par un phage normal. Un cycle lytique peut démarrer.
• Cas rare qui nous intéresse. Infection par un phage défectif qui transporte de l'ADN de la souche donneuse.
Le phage est défectif, aucun cycle phagique. Mais l'ADN injecté peut devenir :
- Recombinaison homologue avec l'ADN de la bactérie receveuse. La bactérie acquiert ainsi un(des) gènes de la donneuse et toute la descendance aussi.
On dit que la transduction est complète.
- Le fragment d'ADN reste libre, il ne sera pas répliqué, mais les gènes transmis sont fonctionnels et
peuvent être exprimés. Au cours des divisions successives, ce fragment sera peu à peu dilué et perdu.
On dit que la transduction est abortive.
Dans une troisième étape, il faudra cribler les résultats
Evidemment, pour visualiser une transduction, il faut disposer d'un crible de culture/sélection pour le(les) gène(s) transduit(s) souhaité(s) et il faut être capable d'éviter qu'une descendance des phages normaux qui seraient issus de cycles lytiques normaux viennent secondairement infecter et lyser les bactéries transductantes ! Avec le phage P1, une façon simple et élégante d'éviter que des descendants phages normaux infectent les transductants d'introduire du citrate de sodium à la fin de l'étape d'infection de la souche receveuse par le lysat phagique donneur (la deuxième étape). En effet, les infections phagiques exigent du calcium libre et le citrate va complexer la calcium et empêcher toute infection ultérieure et ce sans perturber la croissance de E. coli.
Voici la transduction généralisée avec P1 expliquée en quelques schémas dans le cas de la transduction du caractère leu+ (il s'agit de transduire leu+ à une souche leu-)
On infecte la souche receveuse leu- avec ce lysat phagique (MOI=1).
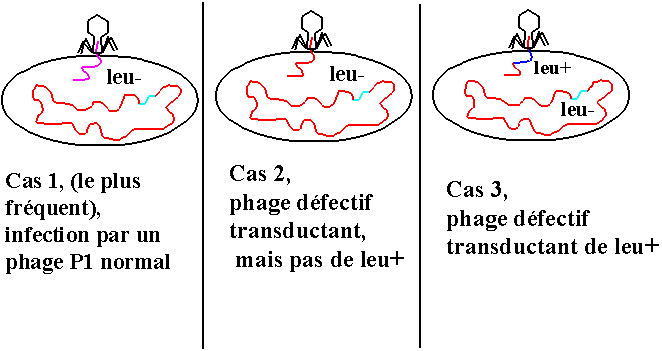
On étale sur milieu de culture dépourvu de leucine (milieu de sélection). Examinons ce qui va se passer pour nos 3 cas.
• Cas 1 : Un cycle lytique démarre. Mais l'absence de leucine dans le milieu et l'utilisation d'une souche leu- va bloquer E. coli et donc le phage. Et on peut utiliser du citrate pour empêcher toute nouvelle infection par une descendance éventuelle.
• Cas 2 : Le phage est défectif et E. coli ne peut se multiplier !!! On ne verra rien !
• Cas 3 : Le phage est défectif, aucun cycle phagique. Mais l'ADN injecté peut donner :
- Le fragment d'ADN va intégrer "leu+" par recombinaison homologue. La bactérie devient leu+,
la culture sur milieu dépourvue de leucine devient possible et toute la descendance de la bactérie
réceptrice portera "leu+". On dit que la transduction est complète.
- Le fragment d'ADN reste libre, il ne sera pas répliqué, mais les gènes transmis sont fonctionnels et
peuvent être exprimés. Au cours des divisions successives, ce fragment sera peu à peu dilué et perdu.
On dit que la transduction est abortive.
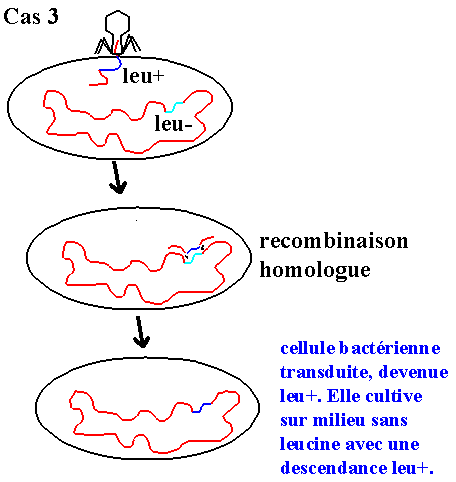
Ce mécanisme de transduction est qualifié de généralisé ou de non spécifique car il concerne tous les fragments d'ADN bactérien (chromosomique ou extra-chromosomique) pourvu que leur taille soit compatible avec une encapsidation. Une autre caractéristique remarquable de la transduction généralisée : les particules phagiques défectives transductantes ne contiennent que de l'ADN bactérien (i.e pas d'ADN phagique).
L'utilisation de marqueurs d'auxotrophie permet de "visualiser" facilement de telles transductions.
La M.O.I. (multiplicity of infection) joue un rôle important dans la transduction. Du fait du faible taux de particules transductrices, il faut réduire au maximum les infections multiples. Et il faut aussi prévenir tout deuxième cycle dinfection qui risquerait dêtre fatal au transductant. Ces 2 paramètres étant maîtrisés, on peut envisager dutiliser les phages comme outils en génétique.