Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour octobre 2012
[A propos de l'auteur]
[Droits de copie]
Pour mesurer une activité catalytique, il faut meurer une vitesse initiale dans un standard donné. Il semblerait que la terminologie suivante soit utilisable :
Remarque : Certaines réactions enzymatiques conduisent à l'apparition ou la disparition de couples acide/base. En se plaçant dans un milieu réactionnel non tamponné de pH éloigné du pK du ou des couples acide/base en cause, la réaction catalysée génère quantitativement ou fait disparaître quatitativement des OH- ou des H+, qu'on peut mesurer au fur et à mesure de la conversion en maintenant strictement le pH du milieu réactionnel à sa valeur de départ par ajout régulé d'un acide fort ou d'une base forte. Ces méthodes un peu particulières de suivi au fur et à mesure sont appelées "par pH-stat"
Vous pouvez ouvrir une nouvelle fenêtre qui propose une " présentation des mesures d'activité catalytique par pH-stat".
On a clairement vu que les mesures d'activité catalytique nécessitaient des conditions standardisées clairement spécifiées (sinon la grandeur extensive "activité" perd toute valeur comparative...)
La notion d'optimisation d'un standard de mesure est une notion qui provient du monde de l'enzymologie clinique et qui signifie qu'un standard de mesure doit être établi :
Remarque : en enzymologie clinique, le standard de température est unique pour toutes les enzymes mesurées : 37°C. Intérêt : température adaptée à la totalité des enzymes d'intérêt clinique, température facile à réaliser y compris dans les pays chauds (un standard à 30°C est très génant dans un pays chaud car refroidir est plus difficile que de chauffer...), une température unique permet une robotisation plus simple sur les robots multiparamétriques.
Le couplage de la réaction dont on souhaite mesurer la vitesse avec une ou plusieurs réactions potentiellement plus rapides mais conduisant à un signal facilement mesuré dans le milieu réactionnel est très utilisé (notamment pour les mesures en enzymologie clinique). Le signal à 340 nm (absorbance) du NADH est le plus classiquement utilisé dans de tels systèmes.
Voici un exemple illustratif concernant l'enzyme alanine aminotranférase.
La valeur de concentration en activité catalytique alanine aminotranférase (ALT, EC 2.6.1.2)est un marqueur utilisé en biologie clinique, en particulier pour le suivi de pathologies hépatiques. Le standard primaire (IFCC, International Federation of Clinical Chemistry) de référence pour les mesures de cncentration en activité ALT met en oeuvre le système de deux réactions couplées suivant :
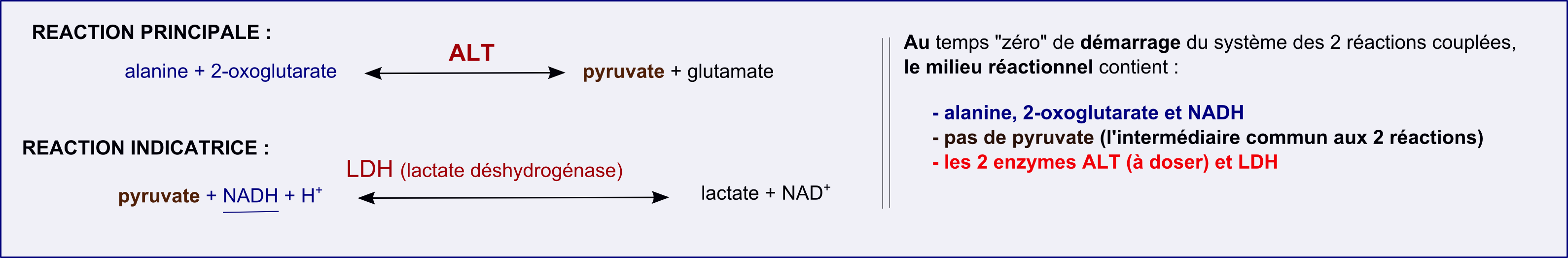
L'objectif est bien celui de mesurer une vitesse initiale de la réaction catalysée par l'ALT (la réaction principale, vi-princ) dans un standard afin de calculer une
concentration en activité catalytique ALT (bALT) selon le très classique :
bALT = zALT/VE = (vi-princ * Vmr)/VE
(avec Vmr volume réactionnel et VE volume échantillon à doser introduit)
Et on va réaliser un suivi direct dans le milieu réactionnel en suivant la réaction indicatrice grâce au signal absorptiométrique à 339 nm fourni par le NADH. La diminution d'absorbance à 339 nm va permettre de suivre la vitesse de la réaction indicatrice, vind.
Le système des 2 réactions couplées ne remplira donc l'objectif que si et seulement si : vi-princ = vind
Comment cela sera-t-il possible ? tout simplement en chargeant le milieu réactionnel avec beaucoup d'enzyme LDH et pas de pyruvate (le réactif commun à la réaction principale et à la réaction indicatrice) :
• En présence des 2 substrats alanine et 2-oxoglutarate, au temps 0 du démarrage du système, la réaction principale va démarrer en vitesse initiale alors que la réaction indicatrice aura une vitesse nulle puisque le milieu réactionnel ne contient pas de pyruvate au départ mais le seul substrat NADH.
• Du pyruvate va donc commencer à s'accumuler à la vitesse de la réaction principale, vformation_pyruvate = vi-princ. Mais si du pyruvate apparaît, alors la réaction indicatrice démarre, d'abord très lentement puisque le pyruvate est nul au départ puis de plus en plus vite puisque du pyruvate s'accumule (vdisparition_pyruvate = vindic). On est en phase pré-stationnaire du système des 2 réactions couplées : vi-princ = vformation_pyruvate < vdisparition_pyruvate = vindic et vdisparition_pyruvate = vindic accélère.
• Si on a suffisamment chargé le milieu réactionnel en LDH, un état quasi-stationnaire va ainsi rapidement apparaître quand on aura atteint vi-princ = vformation_pyruvate = vdisparition_pyruvate = vindic. On aura d[pyruvate]/dt = 0 (la concentration en pyruvate est dynamiquement constante) et vi-princ = vindic.
On dit qu'on s'est placé dans des conditions qui ont rendu la vitesse de la réaction indicatrice limitée par celle de la réaction principale. On écrit souvent cette phrase sous l'autre forme : "la réaction principale est limitante".
Le schéma ci-dessous illustre tout ça.

En pratique, puisque les mesures de concentration en activité ALT concernent des échantillons de plasma, la procédure exacte du standard de mesure utilise un démarrage (starter) avec le substrat 2-oxoglutarate afin de s'affranchir d'un certain nombre de problèmes techniques. En effet l'ALT est une enzyme à coenzyme pyridoxal-phosphate (PLP) lié. Mais la liaison ALT-PLP est labile et l'ALT a tendance à perdre son PLP dans le plasma. Le standard de mesure prévoit donc de recharger toutes les enzymes en PLP avant les mesures afin de réaliser une mesure de l'ALT totale plasmatique. Ceci est réalisé par une phase d'incubation en concetration saturante en PLP. Cette phase est utilisée pour équilibrer en température le mélange réactionnel avant de démarrer en ajoutant le substrat (manquant)2-oxoglutarate. Le schéma ci-dessous illustre tout ça.

Voici la procédure opératoire résumée du standard ALT (procédure complète disponible à Clin Chem Lab Med 2002; 40(7):718724, Reference Procedure for the Measurement of Catalytic Concentration of Alanine Aminotransferase)
Dans une cuve pour photométrie : Un blanc réactif (échantillon remplacé par NaCl 9g/L) doit donner une variation d'absorbance inférieure à 0,002 par minute. Un blanc échantillon (2-oxo-glutarate remplacé par NaCl 9g/L) qi doit donner moins de 1% du signal de l'essai avec échantillon peut être renseigné. |
Concentrations dans le mélange réactionnel fnal (une fois le 2-oxoglutarate ajouté) : |
- Température 37,0°C±0,1°C |
Pour information, le Km alanine = 22 mmol/L et le Km 2-oxo = 0,67 mmol/L. Dans les conditions du standard primaire ALT, on est donc à 22,5 Km pour l'alanine et le 2-oxoglutarate. L'ALT suit un mécanisme ping-pong et le calcul donne que les vitesse initiales ALT sont de 0,91 Vmax. Cette valeur, assez loin de la valeur asymptotique Vmax, est un compromis en raison de problèmes de solubilité avec l'alanine et d'un effet inhibiteur du 2-oxoglu à concentrations élevées.
Pour finir ce paragraphe sur les systèmes à réactions couplées, voici un exemple à 3 réactions couplées, pour les mesures de glycérol-kinase (GK). La GK catalyse la réaction :
MgATP + glycérol = MgADP + glycérol-3-phosphate
Le couplage avec 2 autres réactions catalysées par la pyruvate kinase (PK) et la lactate déshydrogénase (LDH, encore elle!) permet d'aboutir à un signal NADH facilement mesurable à 340nm. Le schéma ci-dessous présente le système des 3 réactions couplées et la terminologie "réaction intermédiaire".
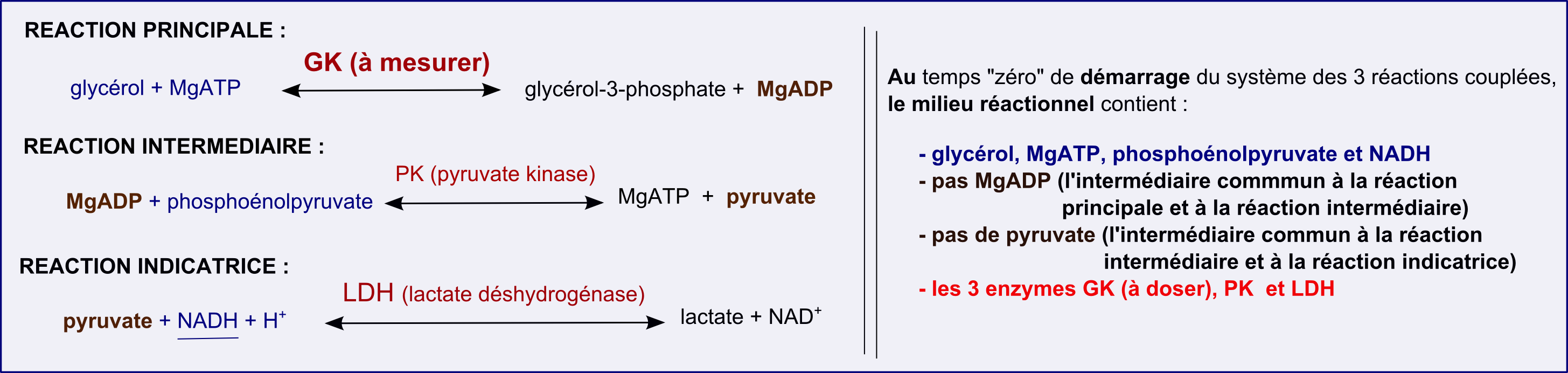
En utilisant suffisamment d'activité PK et LDH dans le milieu réactionnel, la vitesse de la réaction intermédiaire et de la réaction indicatrice sera limitée par la vitesse initiale de la réaction principale (celle qu'on veut mesurer). Après une phase pré-stationnaire (de courte durée), on aura un état stationnaire pour lequel vi-principale = vintermédiaire = vindicatrice avec d[MgADP]/dt = 0 et d[pyruvate]/dt =0.
Rien n'interdit de pratiquer des mesures selon un standard différent d'un standard de référence si on a su le valider en établissant la relation qui relie le résultat obtenu dans le standard local au résultat qu'on obtiendrait en appliquant le standard de référence sur ce même échantillon. Ceci est vrai en biologie clinique par exemple, où de nombreuses méthodes de détermination d'activité catalytique robotisées sont réalisées dans des conditions pas toujours identiques aux standards primaires de référence IFCC mais sont bien opérationnelles car validées et étalonnées à l'aide d'étalons issus des méthodes primaires de référence.
La relation entre activité catalytique et quantité d'enzyme à l'état natif est une relation simple de proportionalité si on considère le cas de préparations enzymatiques contenant une forme unique de l'enzyme étudiée. Dans le cas de préparations enzymatqiues contenant des formes moléculaires multiples de la même enzyme dont les proportions sont vaariables, par exemple des isoenzymes, la relation entre entre activité catalytique et quantité d'enzyme à l'état natif devient très complexe puisque chaque forme enzymatique possède a priori un coefficient catalytique et des coefficients d'affinité pour les substrats qui lui sont propres. Donc à regarder de près, au cas par cas ...