Retours vers :
[Accueil]
[Sommaire du dossier]
JF Perrin mise à jour 2007/2017
[A propos de l'auteur]
[Droits de copie]
![]()
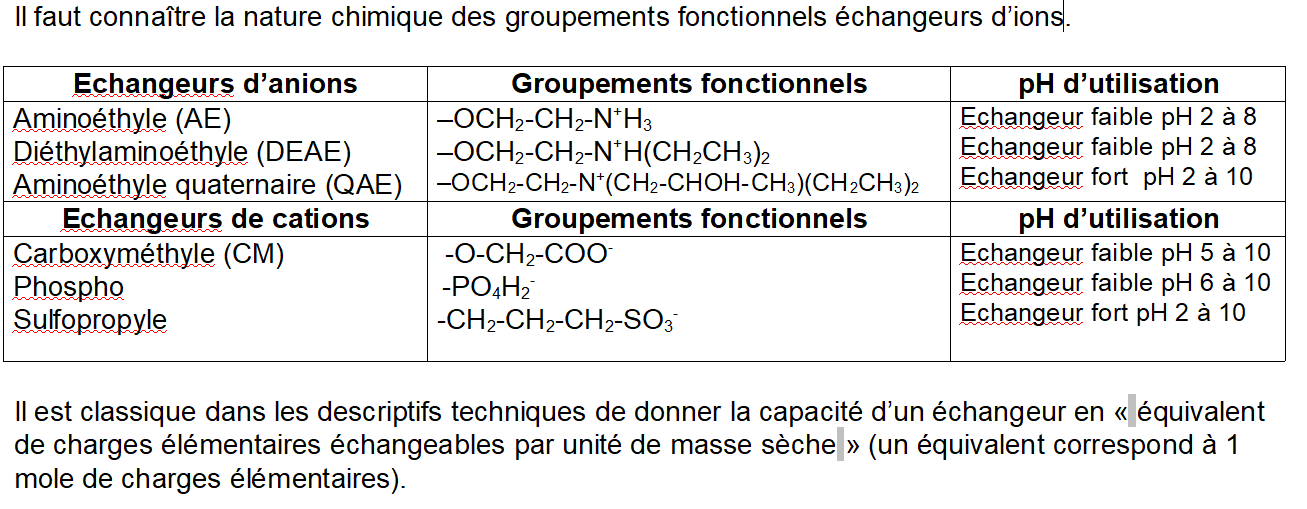
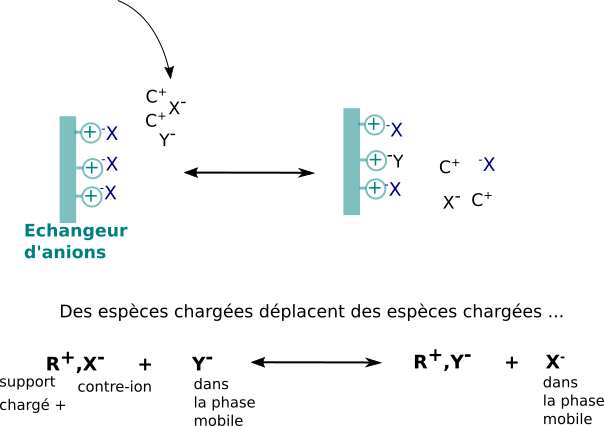
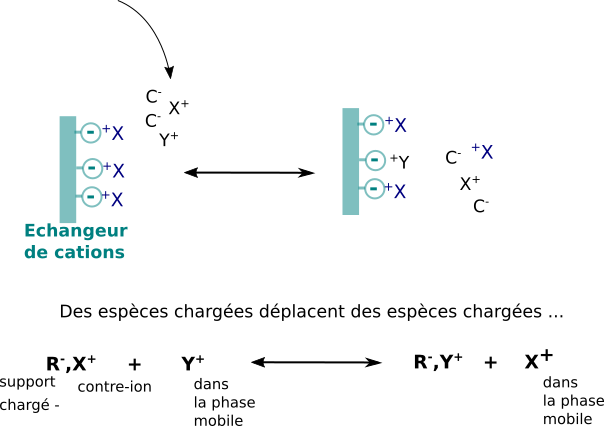
Les phases stationnaires utilisées portent des motifs fonctionnels chargés qui peuvent interagir par interactions ioniques avec des ions de charge opposées. Les supports stationnaires portant des motifs chargés négativement sont dits échangeurs de cations, ceux portant des motifs chargés positivement échangeurs d'anions.
Comme la charge globale est nulle, il faut bien se représenter le processus chromatographique comme une suite d'événements d'échanges en différents "compétiteurs" de même charge pour les charges opposées portées par la phase stationnaire. La notion de contre-ion est fondamentale.
Voici un exemple tiré de "Application Note: Determination of Sulfate and Chloride in Ethanol by Ion Chromatography", Application Note Dionex 175 disponible à http://www.thermofisher.com/order/catalog/product/060549.
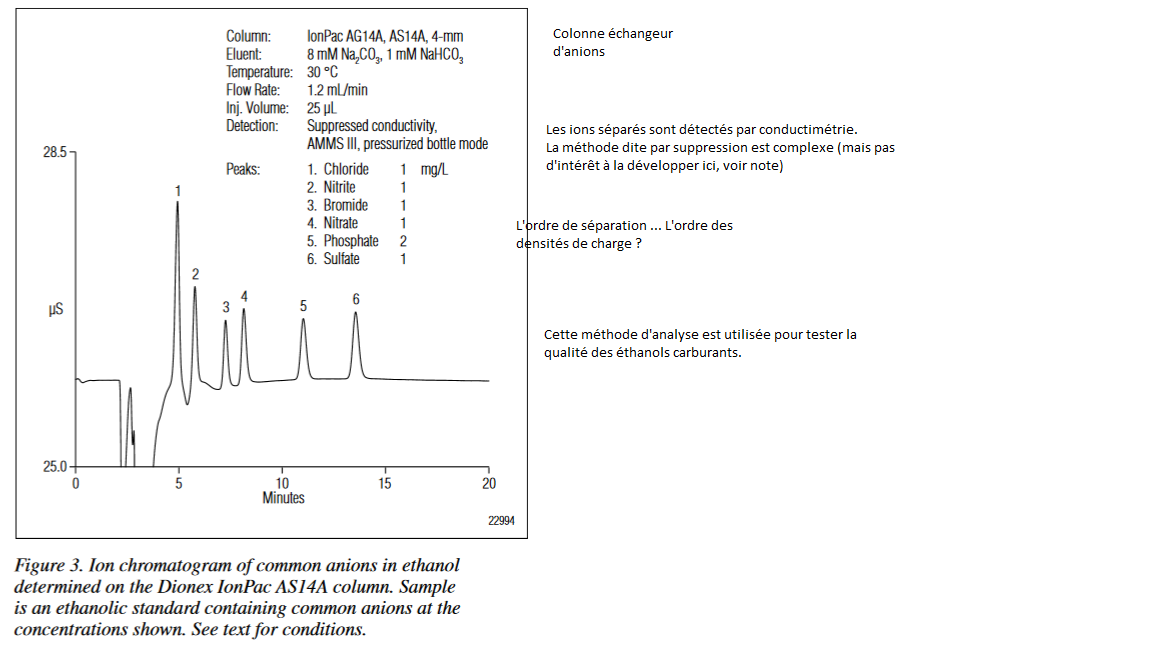
Note : pour la méthode de détection par conductimétrie avec suppression, c'est complexe et pas le propos ici. Ceux qui sont intéressés peuvent consulter l'article complet et se reporter à https://partners.metrohm.com/GetDocument?action=get_dms_document&docid=2249577.
Les techniques de chromatographie d'échange d'ions (IEXC) sont très efficaces pour séparer des peptides et/ou des protéines. Plus qu'une technique analytique, c'est une technique préparative très utilisée pour la purification des protéines. Voir perrin33.com/purifprot/purification_4.php.
La charge nette d'une protéine dépend du pH, les tampons utilisés doivent être strictement définis.
Voici une illustration sur une séparation concernant 3 protéines A, B, C de pHi différents:
Classiquement, en analyses de peptides et protéines, on réalise des gradients d'élution par augmentation de la force ionique de la phase mobile. En pratique très souvent avec du NaCl : élution compétition par les Na+ (cas d'échange de cations) ou les Cl- (cas d'échange d'anions). Le sens des gradients d'élution est toujours de la force ionique la plus faible vers la force ionique la plus forte (on augmente le pouvoir éluant). L'ordre d'élution est a priori celui des pHi décroissants sur échangeur de cations et des pHi croissants sur échangeur d'anions. Cette ordre n'est que "a priori" puisqu'il peut exister des répartitions de charge hétérogènes et des effets stériques qui perturbent...
On peut évidemment envisager des gradients de pH pour éluer des protéines très retenus. Ceci est rarement mis en oeuvre car atteindre des pH "extrêmes" est souvent cause de désagréments et car la réalisation de gradient de pH est techniquement plus complexe que la réalisation d'un gradient de force ionique. On peut quand même retenir que sur échangeur de cations, une phase mobile sera d'autant plus éluante que son pH sera acide. Ainsi tout gradient de pH ira du moins acide au plus acide. A l'opposé, sur échangeur d'anions, une phase mobile sera d'autant plus éluante que son pH sera alcalin. Ainsi tout gradient de pH ira du moins alcalin au plus alcalin.