La "fission binaire" est la forme de reproduction et de division cellulaire la plus commune des procaryotes. Une cellule, après avoir répliqué son matériel génétique, se divise en 2, chaque partie contenant une copie du matériel génétique et 2 nouvelles cellules parfaitement individualisées sont finalement créées, chacune ayant la capacité de croître jusqu'à la taille de la cellule mère d'origine ... La chronologie est la suivante :
- réplication de l'ADN chromosomique bactérien et ségrégation en deux nucléoïdes et phase de croissance cellulaire ;
- assemblage d'un anneau protéique de constriction ;
- constriction de l'anneau associé à la synthèse de paroi jusqu'à individualisation complète des 2 nouvelles cellules.
Note. Rappelons aussi les "ambiguités du français commun", la division cellulaire c'est une cellule bactérienne qui donne 2 cellules filles qui vont grandir, c'est à dire une multiplication par 2 !
Note. Attention, Chez de nombreuses espèces bactériennes les cellules filles parfaitement individualisées après fission binaire restent - au moins un certain temps - physiquement accolées selon des groupements caractéristiques : chainettes (fréquent chez les genres streptocococcus et Bacillus), tétrades (typiques chez Sporosarcina), palissades (rencontrées dans le genre Corynebacterium) ... Ceci ne change rien à leur mode de division par fission binaire !
A propos du terme nucléoïde : Les Bactéries ne possèdent pas de noyau délimité par une membrane. L'ADN qui forme le "chromosome bactérien" (terme impropre mais trèsb utilisé) se trouve concentré dans une zone cellulaire (de forme sphérique ou ellipsoide plus ou mopins allongée) appelée nucléoïde. Le "chromosome bactérien" est attaché à la membrane cellulaire, où sont présentes les protéines nécessaires à sa réplication et à la ségrégation en deux nucléoides. (Rappel : l'ADN bactérien n'est pas lié à des protéines de type histones comme dans les cellules eucaryotes et n'est donc pas du tout compacté comme dans les cellules eucaryotes, mais, évidemment, il est associé à des protéines de compactage.)
Il existe d'autres modes de division des bactéries que la fission binaire, mais moins classiquement rencontées. Evoquons simplement le cas incontournable des Streptomyces où on peut observer, sur les cultures, l'évolution d'un pseudo-mycélium d'abord bien compartimenté vers un pseudo-mycelium avec des compartiments à "chromosomes" multiples (plusieurs dizaines) et finalement la "septation/désarticulation/différenciation" en exospores (à un seul génome par spore)... Pour mémoire, le génome des Streptomyces est linéaire, rare chez les bactéries où la règle est le circulaire...
Note. Une cellule multinuclée (donc à nucléoïdes multiples si on veut étendre la définition aux bactéries) qui résulte de la multiplication des noyaux (des nucléoïdes pour élargir aux bactéries) qui ne se séparent pas au sein de cellules séparées mais restent au sein d'un unique cytoplasme commun est appelée coenocyte. Les Streptomyces peuvent ainsi être considérés comme adoptant une structure coenocytique au cours de leur cycle de développement.
L'occasion de donner aussi une référence internet qui présente le cycle d'un Streptomyces: http://openwetware.org/wiki/Streptomyces:Other_Bits/An_Introduction_to_Streptomyces.
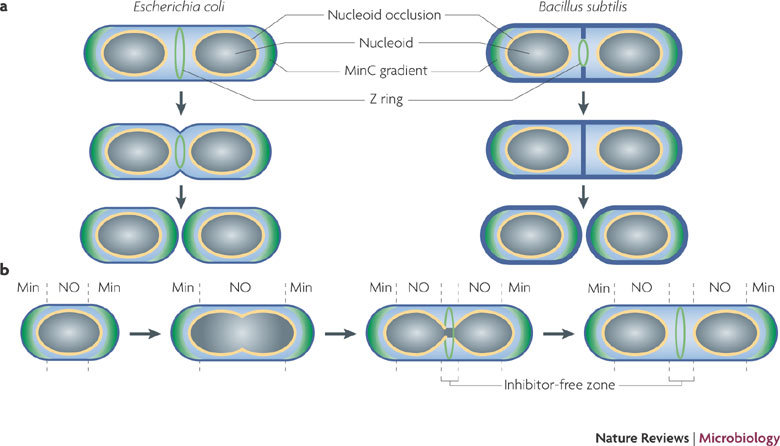
Quoi de mieux que cette très explicite figure tirée de David W. Adams & Jeff Errington, Nature Reviews Microbiology 7, 642-653 (September 2009) et accessible à : http://www.nature.com/nrmicro/journal/v7/n9/fig_tab/nrmicro2198_F1.html.

a | Two different modes of division. After chromosome replication and segregation into nucleoids the Z ring assembles at mid-cell. The ring then constricts to bring about division. Cell wall synthesis follows the ring inwards. In Escherichia coli, synthesis of the division septum is accompanied by constriction of the outer membrane. In Bacillus subtilis, a cross wall of peptidoglycan initially divides the cell before it is degraded and remodelled to form the new, hemi-spherical cell poles. b | The spatial regulation of Z ring assembly. Nucleoid occlusion (NO), which is mediated by Noc (in B. subtilis) or SlmA (in E. coli), inhibits Z ring assembly close to the nucleoid. The Min system acts to prevent Z ring assembly at the cell poles (for simplicity, the Min dynamics in E. coli have been omitted). From left to right: in 'newborn' cells, both systems initially inhibit Z ring assembly throughout the cell; following cell elongation and chromosome replication, NO maintains inhibition in the cylindrical part of the cell; and finally, the progression of chromosome segregation reveals an inhibitor-free region at mid-cell, allowing the Z ring to assemble.
Des photos issues de "Colocalization of cell division proteins FtsZ and FtsA to cytoskeletal structures in living Escherichia coli cells by using green fluorescent protein"; Xiaolan Ma, David W. Ehrhardt , and
William Margolin ; PNAS November 12, 1996 vol. 93 no. 23 12998-13003.
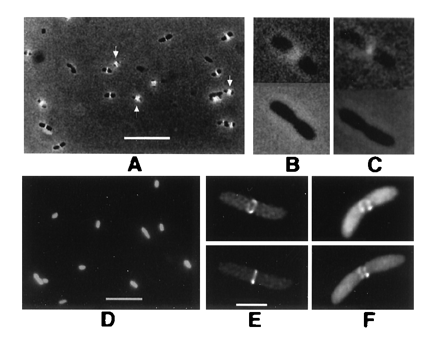
FtsZ–GFP forms (note : les souches génétiquement modifiées créées par les auteurs synthétisent une protéine de fusion FtsZ/GFP ) rings at midpoints of E. coli cells. Cells in A–D were viewed by conventional fluorescence; cells in E and F were imaged by deconvolution. All were from colonies on plates without IPTG. (A) JM109/pZG, showing localization to cell midpoints. Arrows point to double bands. (B and C) FtsZ–GFP fluorescence (JM109/pZG) in cells undergoing visible septation. (Upper) With fluorescence/phase-contrast. (Lower) Phase-contrast only. (D) JM109 containing pCSK100 (GFP only). (E) JM109/pZG cell with FtsZ–GFP ring. Upper and Lower are two different viewing angles of the same cell. (F) Same as E except with incomplete fluorescent ring. (Bars: A and D, 5 μm; B, C, E, and F, 1 μm; bar shown in E only.)